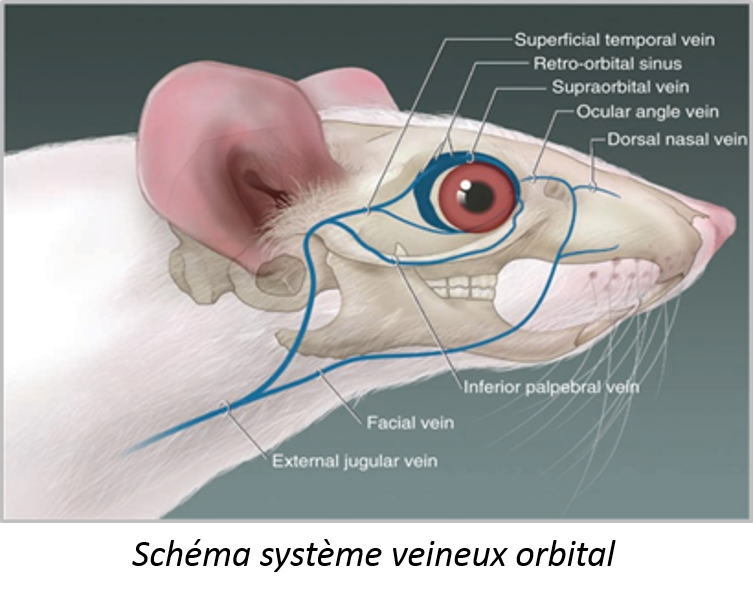
Cette technique de prélèvement sanguin au niveau sinus rétro-orbital (ou sinus périorbitaire ou sinus orbitaire postérieur ou plexus veineux de l'orbite), consiste à effectuer une ponction du sinus veineux derrière le globe oculaire. Ce prélèvement doit toujours être effectuée sous anesthésie générale et seulement sur une orbite. Cette méthode peut être utile pour obtenir de bons échantillons chez des animaux sans queue comme les hamsters ou chez des souris quand le volume requis est plus important que ce qui peut être prélevé au niveau la veine caudale.
Cependant, cette technique est délicate et impressionnante. Le risque d'entraîner des conséquences graves chez l'animal est élevé en cas de gestes mal contrôlés. Aussi ne devrait-elle effectué que par des personnes compétentes.
Méthodologie :
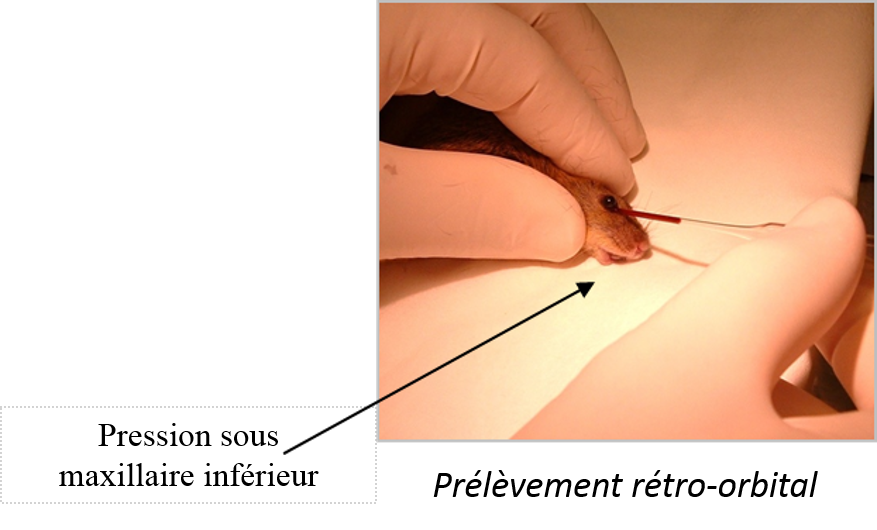
Le prélèvement rétro-orbital s’effectue en écartant la paupière puis à exorbiter par un étirement de la paupière supérieure de manière à récupérer le sang. Puis implanter la pipette Pasteur remplie à 4% du volume à prélever d’anticoagulant, au coin de l’œil, la faire délicatement tourner dans ses doigts pour provoquer une légère irritation de la veine et ainsi récupérer le sang. Dès que le prélèvement est fini, refermer délicatement l’œil en resserrant les paupières. Le sang est déposé dans un tube Eppendorf (ou des microvettes aliquotées d’EDTA selon la manipulation) puis réfrigéré à 4°C dans les minutes suivant le prélèvement.
Il faut ensuite nettoyer l’oeil avec un papier imbibé d’eau l’œil en tapotant légèrement. Replacer ensuite la souris dans une cage propre. Vérifier qu’elle se réveille correctement et qu’aune anomalie n’est survenue suite à l’anesthésie avant de remettre la cage sur le portoir.
Pour les suites de la manipulation, il est possible de garder le sang total ou de le centrifuger pour en obtenir, le plasma ou le sérum. Partant de cet échantillon, on peut réaliser une étude hématologique par exemple grâce à des plateformes spécialisées : service de génotypage ou autre analyses spécifiques.