Les injections intraveineuses se font de deux manières:
Généralités:
Les injections en intraveineuse caudale ou IC
Les injections IC sont réalisées au niveau de la queue de l’animal qui reste vigile. Le principe d’IC est le même lors de prises de sang. Placer l’animal, la tête en premier dans l’appareil à contention prévu à cet effet. La queue sera bloquée avec le morceau de plastique. La souris a moins de risque de bouger au moment de l’injection et donc de se blesser avec l’aiguille.
Pour un meilleur maintien, il est possible de scotcher la queue de la souris pour la maintenir tendue. Cette astuce permet aussi de mieux cibler la veine caudale.

Méthodologie:
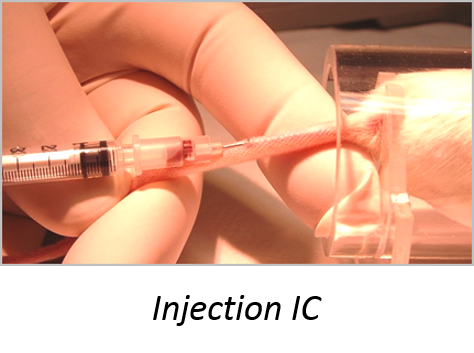
Tamponner l’endroit de l’injection avec un bout de papier imbibé d’eau pour stopper la petite hémorragie causée par l’injection. Replacer la souris dans la cage avec un morceau de sopalin supplémentaire si l’hémorragie persiste.
Les injections intraveineuses en rétro-orbital
Il est possible de passer par la voie orbitaire pour injecter des solutions chez des souris. Attention à bien prendre en compte que ce type d'injection est un acte chirurgical qui est loin d'être anodin. En effet, au même titre que le prélèvement, l'injection est un geste à maîtriser parfaitement afin de ne pas blesser l'animal (perte de la vue) et que les résultats soient exploitables.
Dans la littérature, les auteurs indiquent qu'ils ont régulièrement utilisé cette technique chez la souris adulte pour administrer des volumes allant jusqu'à 150 µl, et ce, sans incident. De Il est préférable d’utiliser par exemple des seringues à insuline, Terumo 1 ml, Terumo Medical Corporation, Elkton, MD montées avec des aiguilles de 29 G ou une seringue à tuberculine (plus petite) de 300 µl à aiguille hypodermique 29 G soudée. Il n’est pas recommandé d’injecter des volumes supérieurs à 150 µl chez l’adulte.
Comme l'aiguille est placée dans l'espace rétro-bulbaire (la région située derrière le globe de l'œil), la souris doit être anesthésiée. C'est un acte chirurgical qui entraîne douleur et stress. Nous préférons utiliser un anesthésique par inhalation comme l'isofluorane par exemple. Cette induction permet une analgésie suffisante. Après l’injection, le réveil est sans complication avec une récupération rapide des paramètres physiologiques. Le principe reste identique à celui d’un prélèvement rétro-orbial. Il faut cependant, rester très vigilant et ne pas appliquer de pression trop forte au niveau du larynx, ce qui pourrait provoquer une asphyxie de la souris.
Attention à prendre soin également de ne pas appliquer une pression excessive sur les vaisseaux cervicaux ventraux, ce qui pourrait empêcher l'écoulement du sang et bloquer l'injection (le liquide ressortirait par la cavité orbitale).
Pour le système orbitaire, il est possible (même parfois recommandé) d’utiliser une solution anesthésique ophtalmique (solution ophtalmique CHLORHYDRATE D'OXYBUPROCAINE THEA 1,6 mg/0,4 ml Collyre en récipient unidose100Unidoses/0,4ml.
Méthodologie :